Hầu hết mọi người đều quen thuộc với việc sử dụng các từ cho các giá trị số như "tá" cho mười hai và "cặp" cho hai. Hóa học sử dụng một khái niệm tương tự với nốt ruồi (viết tắt mol), không chỉ một loài động vật có vú nhỏ mà là số 6.022 x 10 đến sức mạnh thứ 23. Con số chính xác hơn nhiều so với điều đó, nhưng đối với hầu hết các tính toán, điều này là đủ chính xác. Bắt nguồn từ số lượng nguyên tử trong 12 gam carbon-12, nốt ruồi cho phép trọng lượng phân tử của một chất được sử dụng làm yếu tố chuyển đổi giữa mol và gam của một chất.
Viết công thức tính chất với số mol. Công thức hóa học mô tả số lượng nguyên tử cho mỗi nguyên tố trong một chất. Ví dụ, nước có công thức H2O chỉ ra mỗi phân tử chứa hai nguyên tử hydro và một nguyên tử oxy. Số lượng nốt ruồi cho mỗi chất được viết trước công thức với các giá trị của một nốt ruồi không được viết. Hai mol nước được viết là 2 H2O và 1,8 mol nước được viết là 1,8 mol H2O.
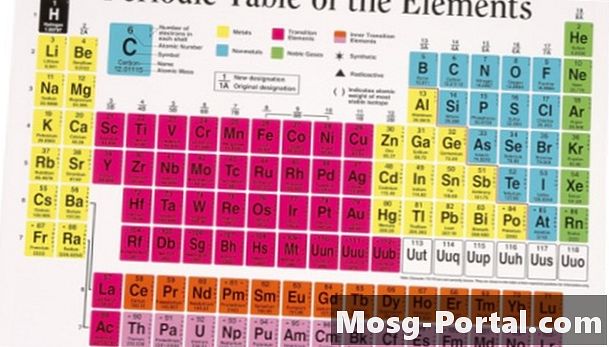
Tổng trọng lượng nguyên tử cho mỗi nguyên tử trong phân tử để tìm trọng lượng phân tử của chất. Trọng lượng nguyên tử được liệt kê trên bảng tuần hoàn bên dưới ký hiệu cho từng yếu tố. Ví dụ, trọng lượng phân tử của nước được tìm thấy bằng cách thêm trọng lượng nguyên tử cho hai nguyên tử hydro và một nguyên tử oxy trong mỗi phân tử. Trọng lượng nguyên tử của hydro là 1,008 và trọng lượng nguyên tử của oxy là 16,00, do đó trọng lượng phân tử là 18,02 (1.008 + 1.008 + 16.00 = 18.02).
Nhân trọng lượng phân tử với số mol cho chất. Trọng lượng phân tử là số gam trên mỗi mol cho chất đó và đưa ra hệ số chuyển đổi cho số mol thành gam cho chất cụ thể đó. Vậy, một mol nước có khối lượng 18,02 gam (1 mol H2O x 18,02 g / mol = 18,02 g). Hai mol nước có khối lượng 36,04 gam (2 mol H2O x 18,02 g / mol = 36,02 g). Phân số của một mol được tính theo cách tương tự sao cho 1,8 mol nước có khối lượng 32,44 g (1,8 mol H2O x 18,02 g / mol = 32,44 g).