NộI Dung
- TL; DR (Quá dài; Không đọc)
- Phân loại propan
- Công thức hóa học của propan
- Cấu trúc propan
- Thuộc tính của Propane
- Công dụng của Propane
Propane là nhiên liệu hóa thạch và là thành phần của khí tự nhiên. Trải qua hàng triệu năm, nó hình thành từ tàn dư hữu cơ của các sinh vật và được khai thác từ các mỏ dưới lòng đất. Khí propan là một hợp chất hữu cơ được tạo thành từ ba phân tử nguyên tử carbon liên kết với tám nguyên tử hydro. Loại liên kết carbon-carbon carbon-hydro xác định cấu trúc của các phân tử propan, theo mô hình tương tự như các loại khí tự nhiên khác như metan và butan.
TL; DR (Quá dài; Không đọc)
TL; DR (Quá dài; Không đọc)
Công thức hóa học của propan là C3H8.
Phân loại propan
Propane được phân loại là một hợp chất hữu cơ vì nó chứa carbon. Nó được phân loại tiếp theo là hydrocarbon vì nó thuộc về một nhóm các hợp chất hữu cơ chỉ được tạo thành từ carbon và hydro. Cụ thể hơn, propane là một loại hydrocarbon được gọi là ankan. Các nguyên tử trong phân tử ankan được giữ với nhau bằng liên kết cộng hóa trị đơn và các nguyên tử carbon luôn tạo thành bốn liên kết cộng hóa trị.
Công thức hóa học của propan
Các ankan theo một công thức chung với tỷ lệ nguyên tử cacbon so với nguyên tử hydro: C_viết sai rồiH2_n+2. Ankan đơn giản nhất là metan, còn được gọi là khí tự nhiên. Nó chứa một nguyên tử carbon liên kết với bốn nguyên tử hydro. Đối với mêtan, viết sai rồi = 1, vì vậy số nguyên tử hydro mà nó có bằng 2 (1) +2 bằng 4. Ethane chứa hai nguyên tử carbon liên kết với nhau và mỗi carbon được liên kết với ba nguyên tử hydro trong tổng số sáu nguyên tử hydro. Propane có chuỗi ba nguyên tử carbon, với công thức hóa học là C3H8, bởi vì một chuỗi ba nguyên tử cacbon cần 2 (3) +2 nguyên tử hydro, bằng tám. Butan, một ankan phổ biến khác được sử dụng làm nhiên liệu trong các ngọn đuốc khí cầm tay, có bốn nguyên tử carbon liên kết với mười nguyên tử hydro, với công thức hóa học là C4H10.
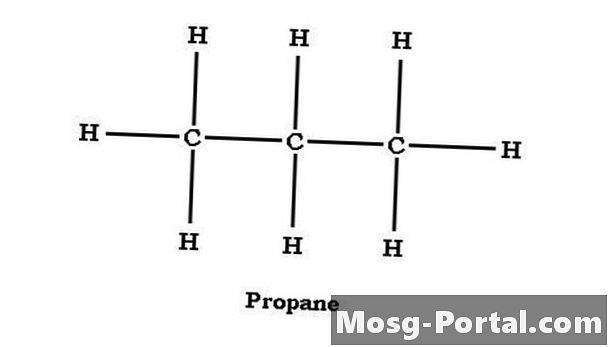
Cấu trúc propan
Các ankan có thể được cấu trúc như chuỗi thẳng hoặc chuỗi phân nhánh. Propane là một ankan mạch thẳng, với các nguyên tử carbon có cấu trúc C-C-C. Carbon giữa chia sẻ một liên kết với mỗi nguyên tử cacbon và có hai nguyên tử hydro. Các nguyên tử cacbon cuối cùng có chung một liên kết với nguyên tử carbon trung tâm và mỗi liên kết với ba nguyên tử hydro. Xét về các nguyên tử carbon riêng lẻ, propan có thể được biểu thị dưới dạng CH3CH2CH3, tương đương với C3H8 nhưng làm cho cấu trúc cánh quạt rõ ràng hơn.
Thuộc tính của Propane
Ngoài những điểm tương đồng về cấu trúc được chia sẻ bởi các ankan mạch thẳng, chúng cũng có chung tính chất tương tự. Propane và các hydrocacbon khác không phân cực. Đặc tính này chỉ ra rằng chúng chỉ có thể trộn với các chất không phân cực khác. Ví dụ, dầu và các loại nhiên liệu khác được làm từ hỗn hợp hydrocarbon. Chúng sẽ không trộn lẫn với một chất cực như nước; sự hấp dẫn giữa các phân tử làm cho dầu và nước tách biệt. Với các ankan mạch thẳng, điểm sôi và điểm nóng chảy tăng khi số lượng phân tử carbon tăng lên. Điểm sôi propan là −44 độ F (−42 độ C) và nhiệt độ nóng chảy − 306 độ F (−189 độ C). Khí mê-tan, chỉ có một carbon, có nhiệt độ sôi thấp hơn propan ở −164 độ C. Octane có tám nguyên tử cacbon và nhiệt độ sôi 98 độ C.
Công dụng của Propane
Do điểm sôi thấp, propan thường được tìm thấy ở trạng thái khí. Khi áp suất và nhiệt độ chính xác được áp dụng cho propan, nó sẽ trải qua một quá trình gọi là hóa lỏng để đẩy khí propan vào trạng thái lỏng. Propane có thể được lưu trữ dưới dạng chất lỏng trong bể điều áp cao hơn điểm sôi của nó. Khí propan hóa lỏng được sử dụng làm nhiên liệu đốt nóng được đốt trong lò điện và máy nước nóng. Nó cũng được sử dụng làm nhiên liệu nấu ăn cho bếp nướng gas ngoài trời và bếp nấu ăn cắm trại chạy bằng gas. Khí propan cũng là một thành phần trong nhiên liệu được sử dụng trong các bình xịt. Propane cũng được sử dụng như một thành phần trong một số loại chất kết dính, chất trám và sơn.